Ֆիզիոլոգիայի և բժշկության ոլորտում 2019 թ․-ին Նոբելյան մրցանակի են արժանացել ամերիկացիներ Ուիլյամ Քելին-կրտսերը՝ Բոստոնի քաղցկեղի ինստիտուտից, Գրեգ Սեմենզան՝ Բալթիմորի Ջոնս Հոփքինսի համալսարանից, ինչպես նաև բրիտանացի Փիթեր Ռեթքլիֆն Օքսֆորդից։
Նոբելյան կոմիտեի հաղորդման համաձայն՝ մրցանակը շնորհվել է «այն մեխանիզմների բացահայտման համար, որոնց օգնությամբ բջիջները զգում են թթվածնի հասանելի մակարդակի փոփոխություններն ու հարմարվում դրանց»։
Գիտնականներն իրենց հետազոտությունները միմյանցից անկախ են կատարել, սակայն նրանք միասին «սակավարյունության, քաղցկեղի և այլ հիվանդությունների դեմ պայքարի համար բազմախոստում մեթոդների մշակման նոր ուղիներ են բացահայտում», ասվում է կոմիտեի հաղորդագրությունում։ BBC-ն կարճ (100 բառով) և ավելի մանրամասն (500 բառով) մեկնաբանում է այդ բացահայտումների իմաստը։
100 բառով
Մեր կողմից ընդունվող սնունդը մեր օրգանների աշխատանքի ու շարժունակության համար անհրաժեշտ էներգիայի վերածելու համար օրգանիզմին թթվածին է հարկավոր։
Կարդացեք նաև
Սակայն արյան մեջ թթվածնի մակարդակը տարբեր գործոնների ազդեցության ներքո անընդհատ փոփոխվում է։ Թե ինչպես են մեր բջիջները հարմարվում այդ փոփոխություններին ու շարունակում իրենց նորմալ գործունեությունը, երկար ժամանակ առեղծված էր համարվում։
Հայտնի է, որ թթվածնի անբավարարության դեպքում մարդկանց ու շատ կենդանիների մոտ թթվածնային քաղց (հիպոքսիա) է զարգանում, որը խանգարում է օրգանների նորմալ աշխատանքին։
Սեմենզայի, Քելինի ու Ռեթքլիֆի աշխատանքները թույլ են տալիս գտնել հիպոքսիայի նկատմամբ ռեակցիայի գենետիկ մեխանիզմն ու հասկանալ, թե ինչպես են բջիջները զգում թթվածնաքաղցն ու հարմարվում դրան, նաև, թե ինչպես է օրգանիզմը սկսում այն հորմոնի արտադրությունը, որը պատասխանատու է արյան՝ թթվածին տեղափոխող նոր կարմիր բջիջների ձևավորման համար։
500 բառով
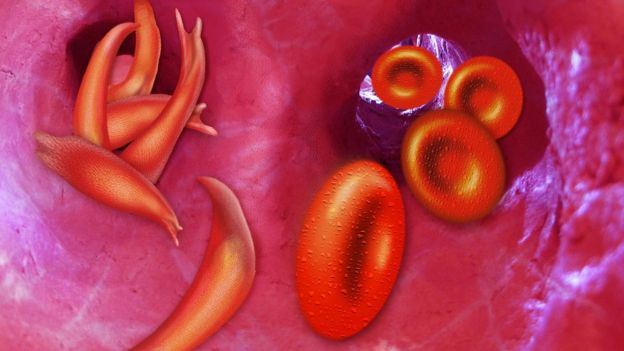
Օրգանիզմում թթվածնի մակարդակից է կախված բջիջներին արյան նորմալ մատակարարումը, առողջ նյութափոխանակությունն ու էներգիան, որն արտադրվում է միտոքոնդրիումների կողմից (որոնք առկա են գրեթե բոլոր կենդանի բջիջներում)՝ սննդի հետ օրգանիզմ ներթափանցող սննդարար նյութերից՝ թթվածնի մասնակցությամբ։
Ընդ որում, բջիջներին հասանելի թթվածնի քանակը կայուն չէ․ այն կարող է նվազել կամ ավելանալ՝ կախված բազմաթիվ գործոններից՝ շնչառության ինտենսիվությունից մինչև օդի որակ, հորմոնալ ֆոն և տարբեր հիվանդություններ։
Ամենապարզ օրինակը, որը ծանոթ է բոլորիս՝ արյան անոթների սեղմումը չափազանց նեղ հագուստի կամ բժշկական լարանի տեղադրման պատճառով։
Երբ թթվածնային անբավարարություն է առաջանում, մեր օրգանիզմը ստիպված է լինում հարմարվել՝ միացնելով խնայող ու փոխլրացնող մեխանիզմները։
Դրա համար բջիջները նախ ինչ-որ հատուկ մեխանիզմի օգնությամբ պետք է «զգան», որ թթվածինն իրենց չի հերիքում․ իսկ թե ինչպես է դա տեղի ունենում, գիտնականները տասնյակ տարիներ չէին կարողանում հասկանալ։
Ընդ որում, այդ հարցն ամենևին էլ աննպատակ չէ, քանի որ այդ մեխանիզմի աշխատանքի խախտումը կարող է հանգեցնել ամենալուրջ հետևանքների․ թթվածնային երկարատև քաղցը կարող է հյուսվածքներում անդառնալի փոփոխություններ առաջացնել։
Թթվածնային անբավարարության նկատմամբ հատկապես զգայուն են սիրտը, լյարդը, երիկամներն ու կենտրոնական նյարդային համակարգը։
Ի՞նչ կապ ունի այստեղ քաղցկեղը
Գիտնականներին վաղուց է հայտնի, որ օրգանիզմում թթվածնի մակարդակին հիմնականում հետևում են քնային զարկերակին հարակից հատուկ ընկալիչները՝ կարոտիդային մարմնիկները։ Երբ թթվածինն անբավարար է դառնում, դրանք գլխուղեղին շնչառության հաճախականությունը կարգավորող ազդակներ են հղում։ Այդ պատճառով մենք, օրինակ, ավելի հաճախ ենք շնչում արագ քայլքի կամ ֆիզիկական ծանրաբեռնվածության ժամանակ։
Բացի դա, դեռ նախորդ դարում գիտնականները բացահայտել են, որ հիպոքսիայի դեպքում Էրիթրոպոետին հորմոնի արտազատում է կատարվում։ Այն արտադրվում է երիկամներում և խթանում է էրիթրոցիտների՝ թթվածնի մոլեկուլները տեղափոխող արյան կարմիր բջիջների արտադրությունը։ Սակայն թե որ մեխանիզմն էր ապահովում այդ արձագանքը, երկար ժամանակ հայտնի չէր։
Փորձարկումներ իրականացնելով մկների վրա՝ Գրեգ Սեմենզան հայտնաբերել է, որ թթվածնի պակասն ինչ-որ կերպ ազդում է ԴՆԹ-ի այն հատվածների վրա, որոնք պատասխանատու են Էրիթրոպոետինի արտադրման համար։
Պիտեր Ռեթքլիֆն այդ երևույթն ուսումնասիրել է զուգահեռաբար, և երկու գիտնականներն էլ հայտնաբերել են, որ թթվածնի անբավարարության մասին բջիջներին «հայտնող» մեխանիզմն աշխատում է գրեթե բոլոր հյուսվածքներում, այլ ոչ թե միայն երիկամներում, որտեղ սինթեզվում է անհրաժեշտ հորմոնը։
Սեմենզան, շարունակելով հետազոտությունը, սպիտակուցային համակարգ է հայտնաբերել, որն այդպես էլ անվանել է՝ HIF՝ «հիպոքսիայով պայմանավորված գործոն»։ Այն կապվում է ԴՆԹ-ի հետ և կարող է արգելակել կամ խթանել Էրիթրոպոետինի արտադրությունը։
Իսկ ինչի՞ց է կախված, թե ինչպիսին կլինի արձագանքը։
Այդ հարցին օգնել է պատասխանել ուռուցքաբան Ուիլյամ Քելինը՝ բոլորովին այլ խնդիր լուծելիս։ Նա ուսումնասիրում էր բավականին հազվադեպ հանդիպող գենետիկ հիվանդություն (Հիպել-Լինդաուի հիվանդությունը), որը լրջորեն մեծացնում է քաղցկեղի զարգացման վտանգը։
Աշխատանքի ընթացքում Քելինը նկատել է, որ դա տեղի է ունենում VHL գենի աշխատանքում եղած խախտումների դեպքում։ Ընդ որում, վնասված գենով քաղցկեղի բջիջները շատ զգայուն են եղել թթվածնի անբավարարության նկատմամբ, սակայն այդտեղ առողջ VHL գենի ներարկման դեպքում արձագանքը կարգավորվել է։
Այդպես բացահայտվել է, որ VHL-ը պատասխանատու է սպիտակուցային HIF համակարգի բաղադրամասերից մեկի քայքայման համար և թթվածնային հագեցվածությամբ պայմանավորված փոխում է դրա ձևը, ինչն էլ հանգեցնում է ԴՆԹ-ի արտահայտչության փոփոխությունների։
Այդպիսով բջիջը «զգում է» թթվածնի անբավարարությունն ու լրացնում այդ պակասը նյութափոխանակության արագության հաշվին։
Եթե հիպոքսիան երկար ժամանակ է շարունակվում, օրգանիզմը թթվածնային քաղցին արձագանքում է նոր արյունատար անոթների շինարարությամբ և էրիթրոցիտների ակտիվ արտադրությամբ։ Օրինակ այդպես են լեռնագնացները պատրաստվում բարձունքների հաղթահարմանը։
Սակայն հենց այդ մեխանիզմն է միանում նոր հյուսվածքի արագ աճի դեպքում, օրինակ՝ քաղցկեղային ագրեսիվ ուռուցքի։ Եվ եթե այն անջատվի, ապա այդ աճը կարելի է դանդաղեցնել, կամ լիովին դադարեցնել։ Հենց այդ պատճառով էլ Քելինի, Ռեթքլիֆի և Սեմենզայի բացահայտումը կարող է լայնորեն օգտագործվել ուռուցքաբանության մեջ։
Պատրաստեց Մարինե ԱԼԵՔՍԱՆՅԱՆԸ